Систему crispr-cas9 удалось заснять в действии
Не обращая внимания на уже более чем десятилетнюю историю изучения совокупности CRISPR-Cas и применения ее для редактирования генома, до сих пор никто не замечал ее за работой. Японские ученые устранили данный пробел и первыми в мире взяли видео этого процесса, применяя скоростной атомно-силовой микроскоп.
Наряду с этим стало известно, что элементы совокупности связываются с молекулами ДНК не так, как считалось ранее: они не ползают по этим молекулам в отыскивании нужного места, а находят его при помощи трехмерной диффузии.
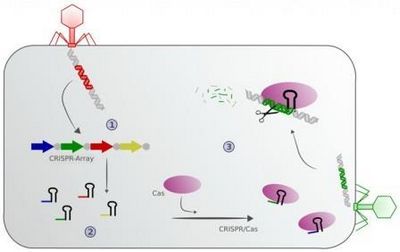
Механизм работы совокупности Crispr-Cas. 1 — участок ДНК вируса, что клетка встретила в первый раз (красный), вставляется в локус CRISPR, где уже сохраняются участки ДНК вирусов, каковые клетка встречала ранее (многоцветные стрелки).
2 — на базе библиотеки CRISPR создаются направляющие РНК, каковые образуют комплекс с белком Cas (лиловые овалы). 3 — В то время, когда комплекс Cas-РНК встречает вирусную ДНК (зеленая), комплементарную направляющей РНК, он соединяется с ней и уничтожает, разрезая на части. Изображение с сайта gesundheitsindustrie-bw.de
Совокупность CRISPR-Cas9, которая употребляется для направленного редактирования генома, завоевала громадную популярность среди ученых. Количество статей, в которых упоминается эта совокупность, быстро растет с каждым годом (начиная с нескольких статей в 2011 году и заканчивая более чем двумя тысячами статей в 2017 году).
Отметим, что CRISPR-Cas — это иммунная совокупность бактерий. Подобно отечественной иммунной совокупности, в которой имеется:
1) клетки памяти, задача которых — запомнить «неприятеля» в лицо и сохранить данные о нем (к примеру, особенная популяция лимфоцитов хранит данные о ранее использованном оружии против возбудителя заразы и формирует вторичный иммунный ответ);
2) клетки, каковые конкретно будут бороться с неприятелем (к примеру, Т-киллеры);
у бактерий также имеется механизм, направленный на уничтожение возбудителей зараз. Лишь у бактерий за иммунитет отвечают не отдельные клетки, а намерено приспособленные для этого нуклеиновые кислоты (ДНК и РНК) и белки.
В базе иммунной совокупности бактерии лежит CRISPR (clustered regularly interspaced short palindromic repeats) — комплекс повторяющихся участков ДНК. Между ними находятся спейсеры — разделители с геномными фрагментами вирусов — генетическими «портретами» тех, с кем эта бактерия уже сталкивалась.
Это — необычная база фотороботов нарушителей в геноме бактерии.
Трудится она так. В случае если в бактерию попал вирус, что она до этого не встречала, и ей удалось его побороть, то на память она покинет маленькой кусок вирусной ДНК, что будет сохранен в локусе CRISPR (рис. 1).
Затем нужно перевести взятую от вируса последовательность нуклеотидов в форму, талантливую нацеливать белки Cas. Для этого создается так называемая направляющая РНК (gRNA), которая повторяет засунутый в базу кусок вирусной ДНК.
В большинстве случаев, направляющие РНК создаются неизменно и с низкой скоростью, но при столкновении клетки с вирусом либо в стрессовых условиях скорость существенно возрастает. По окончании того, как РНК создана, она связывается с комплексом белков Cas.
Сейчас комплекс Cas-gRNA подобно милицейскому с фотороботом преступника, может охранять клетку. В то время, когда отыскан кусок чужеродной ДНК, комплементарный направляющей РНК, комплекс связывается с этим куском и белки Cas расщепляют его, как пара молекулярных ножниц.
Подробнее об этом молекулярном механизме см., к примеру, статью Д. Э. Джагарова Умные ножницы для ДНК.
Открытая практически 30 лет назад, более 20 лет эта совокупность воображала интерес лишь для молекулярных биологов, каковые пробовали осознать свойства этого неповторимого защитного механизма. В 2012 году был распознан потенциал совокупностей CRISPR-Cas9 как инструмента для редактирования генома, талантливого инициировать целенаправленные генетические модификации фактически в любом организме.
В последующие годы с помощью этого способа ученым удалось, к примеру, избавить мышей от генетических болезней (J. R. Mendell, L. R. Rodino-Klapac, 2016. Duchenne muscular dystrophy: CRISPR/Cas9 treatment), вылечить животных от ВИЧ (C. Yin et al., 2017.
In Vivo Excision of HIV-1 Provirus by saCas9 and Multiplex Single-Guide RNAs in Animal Models) а также отредактировать геномы взрослого человека и эмбриона (см. P. Liang et al., 2015. CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes и популярную заметку D. Cyranoski Chinese scientists to pioneer first human CRISPR trial).
Об истории и главных итогах применения этого способа просматривайте в новости Подведены итоги первого десятилетия изучения CRISPR («Элементы», 13.07.2017).
Не обращая внимания на значительные удачи, сейчас не было ни одного прямого наблюдения функционирования данной совокупности. Данный пробел удалось устранить группе японских ученых во главе с Микихиро Шибатой (Mikihiro Shibata) при помощи скоростного атомно-силового микроскопа (HS-AFM), что разрешает приобретать изображения молекул а также отдельных атомов.
Статья об изучении размещена в издании Nature Communications.
Посредством HS-AFM-визуализации возможно выявлять динамику белков с фантастической детализацией. К примеру, ранее ученым, среди которых были и кое-какие авторы обсуждаемой работы, удалось зафиксировать фотоиндуцированные конформационные трансформации в молекуле бактериородопсина (M.
Shibata et al., 2010. High-speed atomic force microscopy shows dynamic molecular processes in photoactivated bacteriorhodopsin) и пронаблюдать за молекулой миозина, прогуливающейся по актиновой нити (N.
Kodera et al., 2010. Video imaging of walking myosin V by high-speed atomic force microscopy).
Принцип работы атомно-силового микроскопа основан на межмолекулярном сотрудничестве между поверхностью исследуемого примера и зондом. Зонд — это наноразмерное острие, которое находится на финише упругой консоли, кантилевера.
Сканируемая поверхность может притягивать либо отталкивать зонд, что ведет к изгибу кантилевера (рис. 2).
Данный изгиб регистрируется при помощи лазера, что, отражаясь от кантилевера, попадает на чувствительный фотодетектор (подробности — в статье А. Курамшина Посмотри на атомы, прикоснись к молекуле). Скоростная атомно-силовая микроскопия трудится по такому же принципу.
Отличие только в том, что употребляется кантилевер, что в тысячи раз меньше, чем применяемый в хорошей АСМ, что разрешает расширить скорость получения изображений.
Ученые сами подготовили нужные молекулы для изучения. Белок Cas9 был синтезирован в клетках кишечной палочки E. coli, а после этого был очищен с помощью колоночной хроматографии.
Направляющую РНК и ДНК-мишень синтезировали in vitro. Кроме этого, была подготовлена особая подложка, на которой потом размещали полимеры.
К подложкам, применяемым для АСМ выдвигаются следующие требования: поверхность должна быть достаточно ровной и прекрасно адсорбировать исследуемые объекты. При сканировании биомолекул значительно чаще употребляются подложки из слюды.
И не смотря на то, что такие подложки имеют гидрофильную поверхность с атомарно-ровными участками размером более 100 мкм, они владеют рядом недочётов, — к примеру, отрицательным зарядом поверхности (что может помешать в работе с ДНК, потому, что фосфатные группы кроме этого имеют отрицательный заряд) и свойством подавлять свободную диффузию комплексов. Для преодоления этих недочётов исследователи модифицировали поверхность слюды двумя различными методами:
1) обрабатывали поверхность слюды раствором APTES ((3-аминопропил)триэтоксисилан), в итоге на поверхности слюды образовывалась пленка, которая в воде имеет хороший заряд.
2) формировали липидный бислой на поверхности слюды, за счет чего минимизировались сотрудничества между комплексом Cas9-РНК и слюдой.
Первое, что сделали японские ученые, — это попытались заснять белок Cas9 без направляющей РНК. Ранее трансформации в белке Cas9, происходящие на протяжении его работы, изучались с помощью рентгеноструктурного анализа (РСА).
Данный способ дает возможность приобрести трехмерную структуру молекулы, к примеру, белка (см. А. Оганов, 10 фактов о кристаллографии).
В случае если кратко, то процесс получения изображения этим способом складывается из таких этапов: изготовление насыщенного раствора белка, что прошел очистку, процесс кристаллизации примера, сбор данных рассеивания рентгеновских лучей и конкретно обработка данных, включающая в себя компьютерное моделирование.
Прошлые изучения продемонстрировали, что молекула Cas9 в свободном состоянии имеет твёрдую структуру. Дабы проверить это, японские ученые забрали кристаллические модели, полученные второй группой исследователей, и сравнили их со собственными изображениями, взятыми на АСМ.
Оказалось, что вольный белок имеет подвижную структуру, хорошую от твёрдой структуры, замечаемой в кристалле . То имеется эти, полученные ранее с помощью РСА, были нерелевантными, поскольку не соответствуют структуре белка в естественном состоянии.
Кристаллические структуры, слева направо: одинокий Cas9, комплекс Cas9-РНК, Cas9-РНК, который связан с одноцепочечной ДНК-мишенью, и Cas9-РНК, который связан с его мишенью (двуцепочечной ДНК). Различными цветами обозначены функциональные домены белка: серо-белый кусок — альфа-спиральная лопасть, розовый — нуклеазный домен HNH, что расщепляет мишень ДНК, светло синий — нуклеазный домен RuvC, что расщепляет цепь нецелевой ДНК, бежевый — PAM домен, распознающий особый кусок ДНК-мишени. c и d — последовательные изображения, полученные с помощью скоростного атомно-силового микроскопа: одинокий Cas9 (c) и комплекс Cas9-РНК ( d ). Мелкий хвостик, указанный стрелкой, это кусочек РНК, торчащий из альфа-спиральной лопасти.
Шкалы справа показывают высоту объекта над подложкой. Изображение из обсуждаемой статьи в Nature Communications
После этого исследователи засняли комплекс Cas9 с направляющей РНК. В отличие от одинокого белка, комплекс Cas9-РНК имел стабильную двулопастную архитектуру, соответствующую кристаллической структуре.
Следующим шагом стала визуализация связывания комплекса Cas9-РНК с ДНК-мишенью. Для начала на поверхность подложки адсорбировали всех «участников»: молекулярные комплексы Cas9-РНК и ДНК-мишени.
На видео возможно подметить, что комплекс Cas9-РНК своеобразны связывается со своей ДНК-мишенью. Все это было совершено в отсутствие ионов магния Mg2+.
Ионы этого металла нужны для верной работы нуклеаз, исходя из этого без магния комплекс связывается с ДНК, но предстоящего расщепления не происходит.
Комплекс Cas9-РНК, своеобразны (то имеется в конкретном месте, в котором будет происходить разрезание) связанный со своей мишенью в отсутствие ионов Mg2+, не разрезает ДНК. Изображение из обсуждаемой статьи в Nature Communications
Дабы визуализировать процесс разрыва ДНК, исследователи повторили прошлый ход, но уже добавили магний. Тогда белок Cas9 смог разрезать ДНК.
На видео показано, как по окончании внесения двухцепочечных разрывов часть ДНК высвобождается из комплекса.
Комплекс Cas9-РНК разрезает молекулу ДНК
Из-за недостаточного разрешения изображений, к сожалению, осталось малоизвестным, как освобождается оставшаяся в комплексе часть молекулы ДНК.
Кроме этого ученым удалось опровергнуть теорию о том, как как раз комплекс Cas9-РНК связывается с нужным участком на молекуле ДНК: ранее считалось, что белок, который связан с РНК, «скользит» по ДНК в отыскивании комплементарного участка. Для этого исследователи применяли подложку с билипидным слоем, дабы минимизировать сотрудничество между белком и слюдой, которое может помешать свободной диффузии комплекса.
Оказалось, что Cas9 без направляющей РНК связывается с молекулой ДНК и просто скользит по ней. А вот в то время, когда у белка имеется РНК, комплементарная нужному участку, комплекс не скользит, а напрямую связывается с мишенью . По всей видимости, наличие направляющей РНК мешает комплексу Cas9-РНК «оседлать» ДНК, дабы скользить по ней.
Так что связывание является следствием трехмерной диффузии: комплексы плавают в растворе, а вдруг им повезет появляться рядом с нужным участком ДНК, то они с ним связываются.
Эти зернистые и, казалось бы, неказистые видео заставляют ученых в мире задыхаться от восхищения. С одной стороны, совокупность CRISPR-Cas9 трудится так, как и предвещали ранее.
С второй стороны, уже выявились новые подробности в том, как протеиновый комплекс связывается с верным участком ДНК. В целом же это изучение предоставляет беспрецедентные подробности о функциональной динамике CRISPR-Cas9 и подчеркивает потенциал скоростной атомно-силовой микроскопии для выяснения механизмов действия молекул, ассоциированных с нуклеиновыми кислотами.
Статья размещена в издании Nature Communications
Источник: Анастасия Пашутова elementy.ru
Дженнифер Доудна: Сейчас мы можем редактировать ДНК. Но давайте покажем благоразумие