Как исправить человека. crispr/cas9: новейшая система генной модификации, которая обещает изменить нашу жизнь
Фантастические, пугающие многих истории о вмешательстве в человеческий геном много лет оставались как раз фантастическими. Но сейчас таковой способ имеется: заимствованная у бактерий совокупность разрешает вести генетическую модификацию любых организмов с высокой точностью.
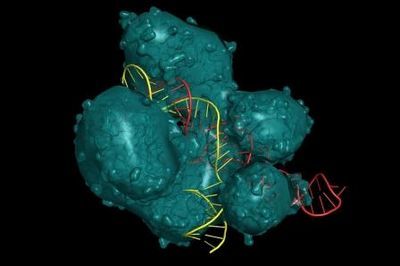
Визуализация совокупности CRISPR-CAS9
© Ibreakstock / Фотодом / Shutterstock
Иммунитет
– естественный «иммунитет» бактерий, химическая совокупность защиты от вирусов, которая требуется одноклеточным организмам, неспособным поддерживать такую сложную иммунную совокупность, как отечественная. Первые намеки на ее существование были отысканы еще в конце 1980-х, в то время, когда Йошизуми Исино и его сотрудники изучили обычную кишечную палочку, правильнее говоря, один ее малопримечательный ген (iap).
На всякий случай японцы секвенировали его последовательность вместе с участками по бокам от него: может, в том месте будут какие-то фрагменты, участвующие в регуляции активности iap?.. Вместо этого биологи нашли в ДНК долгие последовательности повторяющихся, совсем аналогичных повторов длиной ровно 29 нуклеотидов.
Между ними – как сухие растения между листами бумаги в гербарии – были «проложены» маленькие фрагменты длиной по 32 нуклеотида, каковые не повторялись никаким образом.
Позднее эту необычную часть ДНК назвали «систематично сгруппированные, поделённые маленькие палиндромные повторы» – Clustered Regularly Interspaced Short Palindromic Repeats. В остальном работы над ними на долгое время остановились, не смотря на то, что многие ученые заинтересовались таинственными участками хромосомы, а кое-какие кроме того рассуждали об их роли.
Функциональное значение CRISPR оставалось тайной, да и особых прорывов никто от них не ожидал: «Биологическое значение этих последовательностей неясно», – написал тогда Исино с соавторами.
Но во второй половине 1990-х начался настоящий бум секвенирования. Установить последовательность ДНК становилось все несложнее, и геномы все новых и новых организмов стали пополнять компьютерные базы разрешённых и анализироваться со всех сторон.
Загадочная – и помой-му тщетная, совсем не похожая ни на какой ген – последовательность CRISPR обнаруживалась у бактерий везде. Нидерландский биолог Рууд Янсен увидел, что они постоянно соседствуют с генами одних и тех же белков.
Функции их тогда были также малоизвестны, и их назвали легко «белками, ассоциированными с CRISPR» (CRISPR-Associated Proteins, Cas).
Упрощённая схема строения CRISPR
©wikipedia
И только в 2005 году сходу три группы исследователей сказали, что неповторимые участки CRISPR – это фрагменты вирусных геномов. «Тут у меня что-то щелкнуло», – вспоминал потом широко узнаваемый биоинформатик и эволюционист Евгений Кунин. К тому времени он уже пара лет бился над тайной CRISPR – и, наконец, его озарило: эта ДНК возможно частью антивирусной защиты бактериальной клетки.
Эта мысль понравилась биологу Родольфу Баррангу, что в то время трудился в компании Danisco, создающей йогурты. В этом бизнесе вирусная эпидемия среди молочнокислых бактерий способна принести важные убытки, и исследователь искал способы защиты от нее.
Дабы проверить догадку Кунина, он заразил стрептококков Streptococcus thermophilus двумя штаммами бактериофагов. Большая часть бактерий погибло, но выжившие были достаточно устойчивы к этим вирусам.
Секвенировав их ДНК, ученые подтвердили: в ней показались следы встречи.
Инструмент
Дженнифер Дудна и Блейк Виденхефт взялись за изучение структуры белков Cas: сейчас стало известно, что они делают роль нуклеаз, другими словами разрезают ДНК. Не обращая внимания на все находки, значение открытия так же, как и прежде было неясным: «У вас нет никакой определенной практической цели, – растолковывала Дудна трудившемуся в ее лаборатории Виденхефту. – Принципиально важно только осознать, как это трудится».
Но по мере работы выяснились многие необычные подробности.
CRISPR – это, вправду, что-то наподобие гербария, каталог, в котором бактериальная клетка сохраняет образцы, фрагменты геномов вирусов, с которыми доводилось сталкиваться ей либо ее предкам. Пользоваться этим каталогом смогут особые белки, ассоциированные с CRISPR (CRISPR-Associated Proteins, Cas).
Ориентируясь на эти образцы, они скоро выявят новые вирусные гены и разрезают их, выводя из строя.
Биолог Карл Циммер растолковывает работу совокупности CRISPR/Cas так: «По мере того, как область как следует заполняется вирусной ДНК, она делается главной «галереей» в клетке, где представлены «портреты» микробов, с которыми бактерии доводилось видеться. Потом эта вирусная ДНК может употребляться для «наведения» правильного орудия Cas-белков».
Для этого бактериальная клетка синтезирует на сохраненных фрагментах ДНК маленькие образцы, молекулы РНК. Любой из этих РНК-«экскурсоводов» (гРНК) связывается с белком Cas, талантливым разрезать ДНК, подходящую под данный пример.
Эти комплексы всегда патрулируют клетку, отслеживая появление любой ДНК и сопоставляя ее с гРНК. В случае если совпадение имеется, двойная спираль ДНК тут же разрезается на части и инактивируется. «Когда мы поняли Cas в качестве программируемых, разрезающих ДНК ферментов, случился увлекательный момент, – вспоминала потом Дженнифер Дудна. – Мы вскрикнули: «Боже, да это же возможно инструментом!»»
Сейчас выяснено целое семейство белков Cas, но самый изученным и освоенным был протеин Cas9, выделенный из бактерий Streptococcus pyogenes – возбудителей скарлатины. Именно он лег в базу новейшей методики генетической модификации живых организмов CRISPR/Cas9, методики, дающей слово невиданный прорыв в биотехнологиях, медицине и сельском хозяйстве.
Модификация
В действительности, белок Cas9 – это нуклеаза, другими словами фермент, разрезающий ДНК. Для любого способа генетической модификации – удаления либо добавления целевых активных генов в организм – эта свойство играется главное значение.
Дабы копировать и вставлять, необходимо вырезать, причем делать это в строго определенном месте. До сих пор с точностью у генетиков были неприятности.
Отыщем в памяти, что молекула ДНК – это, по молекулярным меркам, поразительно долгая цепочка, неспециализированная протяженность которой в каждой хромосоме каждой отечественной клетки достигает порядка сантиметров. Разнообразием данный полимер не отличается, состоя всего из четырех различных звеньев: аденина (А), гуанина (Г), тимина (Т) и цитозина (Ц), каковые повторяются миллионы и миллионы раз.
Отыскать в этом однообразии как раз необходимый участок неимоверно сложно.
Продолжительное время в распоряжении генетиков имелись только совокупности с нуклеазами, каковые распознавали маленькие участки – к примеру, четыре нуклеотида АТЦЦ либо ТГЦА, – которых в течении цепочки смогут видеться сотни и десятки. В следствии разрезы производились в случайном из этих мест, и только усердная работа разрешала отобрать клетки, в которых данный процесс состоялся в нужном участке генома.
В отличие от них, вооруженный гРНК белок Cas9 выявит фрагмент длиной с эту РНК – около 20 нуклеотидов. Такие участки уже, в большинстве случаев, вовсе не повторяются в ДНК кроме того высших организмов.
Более того, сама структура комплекса Cas9 с гРНК определяет простоту работы с ней. Достаточно открыть в компьютере базу с ДНК нужного организма, отыскать фрагмент, что должен быть разрезан, и синтезировать молекулы гРНК с той же последовательностью оснований (и заменой тимина, роль которого в РНК играется урацил, У).
Cas9 – нуклеазы неразборчивые и будут резать ДНК где угодно, только бы гРНК совпала.
В отличие от этого, совокупности генетической модификации прошлых поколений потребовали продолжительной работы по синтезу и проектированию ферментов-нуклеаз, талантливых распознавать определенные участки ДНК. К примеру, способы с применением связывающихся с ДНК «цинковых пальцев» ZFN (Zinc Finger Nuclease) либо белков TALEN (Transcription Activator-Like Effector Nucleases) теоретически разрешают трудиться с еще более долгими фрагментами ДНК.
Но для каждой конкретной задачи их приходится проектировать раздельно.
Наконец, CRISPR/Cas9 универсален по отношению к различным видам модифицируемых организмов. Способ несложен и действен и, по крайней мере, теоретически с однообразным успехом подходит чтобы получить рис с повышенным содержанием витамина А либо лосося, набирающего массу в два раза стремительнее простого, для внесения новых генов либо замены дефектных у людей и племенных лошадей… Но перед тем как перейти к людям, давайте «потренируемся на кошках».
А лучше – на мышах.
Мыши, люди и все-все-все
Представим, что нам требуется взять мышей-альбиносов, дабы изучить, как воздействует это состояние на здоровье различных совокупностей организма у людей. Для этого направляться «отключить» обе копии гена, связанного с синтезом пигмента меланина.
В случае если мы привержены классическим подходам к генетической модификации (кстати, в основном также заимствованным у бактерий), то нам стоит запастись терпением.
Для начала нам направляться синтезировать «ген альбиносости» и взять мышиные эмбрионы на самых первых этапах развития. После этого в их ядра через узкую полую стеклянную иглу внести новую ДНК.
В делящихся клетках происходит рекомбинация – обмен гомологичными участками хромосом – так что, трижды сплюнув, будем сохранять надежду, что она захватит и необходимый нам фрагмент. Способом ошибок и проб, нескончаемыми повторами и отбраковыванием мы можем взять мышей, каковые взяли одну копию «гена альбиносости» и были способны передать ее потомству.
После этого, скрещивая таких животных, непременно мы добьемся рождения особей с заменой обеих копий. Возможно выжидать, а лучше сходу переходить на CRISPR/Cas9.
Вправду, чтобы получить тех же мышей-альбиносов, достаточно отыскать пограничные участки отечественного целевого гена и синтезировать для них гРНК, по окончании чего ввести в эмбрион вместе с белками Cas9 и ДНК нового гена. Подхватив гРНК, нуклеазы Cas9 разрежут обе копии гена по краям, по окончании чего в дело включатся клеточные совокупности репарации, важные за поддержание целостности генома.
Это очень важная задача, исходя из этого белки репарации действуют скоро а также грубо. Найдя повреждение ДНК – тем более такое страшное, как двухцепочечный разрез, – они готовы подхватить первый попавшийся кусок ДНК, практически «затыкая» появившуюся брешь.
Так что в случае если в клетке окажется достаточно нужных нам фрагментов, в место, разрезанное белками Cas9, будут встроены они.
Недаром за прошедшее с момента открытия CRISPR/Cas9 генетическая модификация совершает прорыв за прорывом. Громкое заявление китайских биологов – тому только один из примеров.
КНР остается страной с одним из самых мягких законодательств в области генной инженерии. Кроме того в Англии, где разрешены опыты по применению CRISPR/Cas9 на людских эмбрионах, оказавшихся химер требуется уничтожать в возрасте не старше 14 дней.
В Китае дозволяется куда больше.
Такие работы поразительно перспективны: практически сейчас продемонстрировано, что CRISPR/Cas9 разрешает редактировать гены кроме того во взрослом организме, очищая ДНК Т-лимфоцитов от заразившего их ВИЧ. А в том же Китае ученые (не через чур удачно) пробовали взять эмбрионы, устойчивые к данной инфекции.
Сейчас же речь заходит о борьбе с раком. Для этого медики собираются отредактировать ДНК тех же Т-лимфоцитов – правильнее говоря, ген белка PD-1, что в норме держит их под контролем.
Деятельный ген PD-1 блокирует свойство Т-лимфоцитов атаковать собственные клетки организма и предотвращает развитие аутоиммунных болезней. Но при рака такая свойство пришлась бы весьма к месту, и ученые планируют, забрав клетки у настоящих онкологических больных, поменять ген PD-1 посредством CRISPR/Cas9 (сейчас мы в общем понимаем, как это возможно сделать).
Вернув в организм эти лимфоциты, авторы ожидают, что те начнут размножаться и атаковать опухоль.
Рак и ВИЧ – только пара громких примеров. Но в будущем CRISPR/Cas9 и генетическая модификация разрешат избавиться от множества вторых заболеваний.
Тем более что множество тяжелейших состояний связаны с нарушением в работе всего одного гена: их, по всей видимости, исправить будет куда несложнее, чем вылечить тот же рак. В отличие от них, ум и доброта, красота либо спортивные свойства – продукт работы массы различных генов, других факторов и воспитания среды.
Так что CRISPR/Cas9 принесет только пользу, а применять ее во вред вряд ли окажется. Разве что .
Источник: naked-science.ru
“Sistemas CRISPR-Cas, una revolucion biotecnologica con origen bacteriano”, Dr. Francisco M. Mojica